2017年08月31号,诺华官方宣布FDA已经批准其CAR-T细胞疗法Kymriah(Tisagenlecleucel,CTL019)上市,用于治疗难治反复性B细胞前体急性淋巴性白血病(Acute lymphoblastic leukemia,ALL),药物曾获得获得了突破性疗法认定和优先审评。
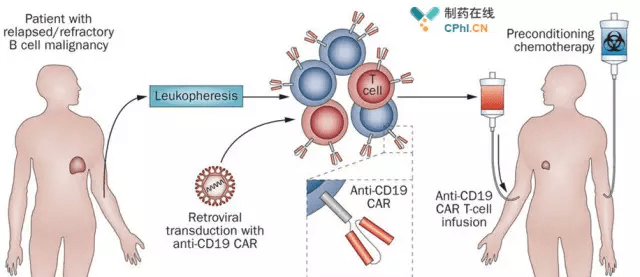
至此,诺华全球瞩目的CAR-T细胞产品CTL019走完上市路的最后一公里,虽然这在2017年07月12号已经毫无悬念,但是依旧让人充满期待。
此次获批意义重大,虽然细胞免疫疗法依旧有着无法克服的自身局限性,但是药物给病情危重病人以最后的希望,笔者认为基因和细胞疗法等新技术将会更为成熟并给人类健康带来更多的奇迹。
诺华CAR-T细胞产品的获批上市使其在细胞免疫疗法竞争中优势尽显,随着上市的临近CAR-T细胞产品的定价也备受瞩目,如何给该产品一个合理的价格,值得关注。
2017年03月份,华尔街著名投行jefferies分析师指出基于临床价值的价格评估中(只考虑年轻患者),CTL019价格将会在60万美金上下。最新消息,该款重磅产品定价50万美金,诺华可能将会采用"以临床疗效付费"方案,但是该方案被认为可能侵害患者隐私但是这还未最后确定,需要与美国相关机构最后讨论。
另外,CAR-T细胞的生产流程、包装、以及运输都是研发公司将要面临的巨大挑战,消息显示Cryoport将为CAR-T疗法Kymriah(CTL019)提供低温物流和运输的支持。
诺华提交FDA Tisagenlecleucel(CTL-019)的上市申请获得优先审评资格,ELIANA 临床研究(NCT02435849)是支持该申请的核心数据,具有惊人的完全缓解率。
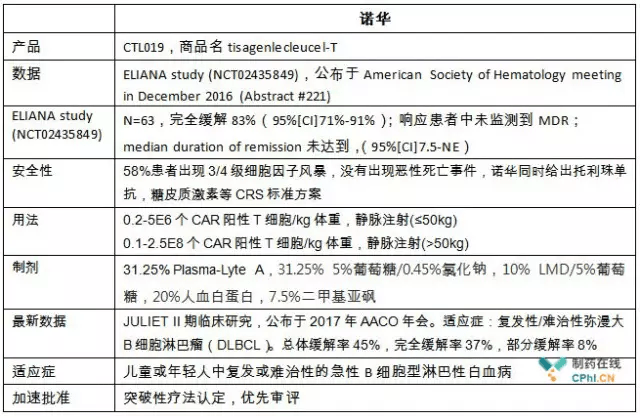
笔者当然期待Emily幸运能够更多的出现,甚至成为临床常态。目前看来,尽管CTL019展现出了惊人的疗效,并获得FDA批准,但其规模生产的稳定性、长期的毒性,以及市场的认可程度等尚需时间检验,真正获得患者认可,成本降低,成为更为成熟的商业产品,造福患者,还有相当长的一段路要走。
来源:CPhI制药在线